
版权所有:沈阳绿洲制药有限责任公司
盐酸奥布卡因凝胶对ICU男性患者围术期导尿燥动的影响
2018-10-24 15:38
盐酸奥布卡因凝胶对ICU男性患者围术期导尿燥动的影响
林静丽,梁燕金,梁天英,廖伟燕*
(中山市小榄人民医院ICU,中山广东528415)
摘要:目的探讨盐酸奥布卡因凝胶对ICU男性患者围术期导尿燥动的影响。方法选择入住我院ICU男性患者120例,随机分为观察组和对照组各60例,观察组采用盐酸奥布卡因凝胶作为润滑剂导尿,对照组采用石蜡油作为润滑剂导尿。观察导尿插管过程中患者平均动脉压(MAP)、心率(HR)的变化;导尿插管中及置管后疼痛及躯体不适感;导尿成功率及不良反应。结果两组导尿前MAP、HR患者比较差异均无统计学意义(P>0.05);观察组导尿插管时MAP、HR均较对照组明显降低(P<0.05),在插管中以及插管后各项指标优于对照组(P<0.05),两组一次性导尿成功率、尿道黏膜损伤率比较差异均无统计学意义(P>0.05);疼痛程度明显低于对照组(P<0.05)。结论采用盐酸奥布卡因凝胶作为润滑剂导尿,能够维持血压稳定,减少躁动及疼痛不适感,可在ICU男性患者导尿术中使用。
关键词:盐酸奥布卡因凝胶;ICU患者;导尿术
中图分类号:R473.6文献标识码:B
文章编号:2095-4646(2017)03-0264-03
DOI:10.16751/j.cnki.2095-4646.2017.03.0264
ICU病房患者因病情较严重,治疗需要导尿,而导尿治疗中因患者抵触或出现不适易导致导尿失败,尤其男性患者,因其尿道口狭窄、尿道弯曲等解剖特点,使导尿插管以及尿管留置过程中引起患者的恐惧应激反应及躁动等,从而影响预后[1]。因此,为围术期ICU男性患者选取合适导尿方式和导尿管,减少患者痛苦,提高一次性置管成功率,降低导尿管置管的并发症,我们现探讨盐酸奥布卡因凝胶对ICU男性患者围术期导尿燥动的影响。
1资料与方法
1.1一般资料选择2014年7月至2015年6月入住我院ICU的男性患者120例,将尿道损伤、前列腺增生、尿道狭窄畸形以及双上肢活动受限的患者排除在外。所有患者年龄20~80岁,平均(44.6±2.3)岁,严重创伤61例、脑外伤42例、消化道大出血17例,随机分为观察组和对照组各60例,两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法两组患者均采用16G导尿管导尿,严格无菌操作原则,观察组采用盐酸奥布卡因凝胶作为润滑剂,用盐酸奥布卡因凝胶软管经尿道外口注入7mL凝胶,注入完毕后对尿道外口进行压闭,并按摩会阴部,将剩余的3mL奥布卡因凝胶涂抹于尿管上,2min后可行常规导尿。对照组患者导尿采用石蜡油作为润滑剂,将石蜡油均匀涂抹于导尿管上再行导尿。
1.3观察指标①观察并记录导尿术前30min和导尿插管过程中两组患者的平均动脉压(MAP)、心率(HR)的变化。②在导尿过程中患者产生的疼痛和躯体不适感等指标参考Riker镇静和躁动评分(Sedatian-Agitation Scale,SAS),分为:服从指令,较配合(安静配合);轻度烦躁、焦虑,劝说后配合(躁动);较为躁动,需采取保护性的约束,不配合(非常躁动);完全不配合、不耐受,需多人协助制动(危险躁动)[2]。③导尿的不良反应有尿道黏膜损伤、疼痛。其中疼痛指标参照视觉模拟评分(Visual analogue scale,VAS),总分10分,0分为无痛,1分为最轻度的疼痛,10分为最严重疼痛[3]。评分时向患者详细解释,并请患者自己做出选择。尿道黏膜损伤指标以肉眼血尿出现作为判定标准:肉眼观察尿液澄清,呈黄色(无肉眼血尿);尿液呈淡红色(轻度血尿);尿液呈洗肉样(中度血尿);尿液呈血性,见血凝块(重度血尿)。④一次性导尿成功:一次性顺利导出尿液为成功;否则为失败[4]。
1.4统计学方法统计学分析应用SPSS 17.0统计学软件进行分析,计量资料以均数±标准差(珋x±s)表示,组间比较采用方差分析,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2结果
2.1两组患者导尿前及插导尿管时MAP、HR的变化两组导尿前MAP、HR比较差异均无统计学意义(P>0.05);导尿插管时观察组MAP、HR均较对照组明显降低(P<0.05),见表1。
表1两组患者导尿前和插导尿管时MAP、HR的变化比较(x±s)
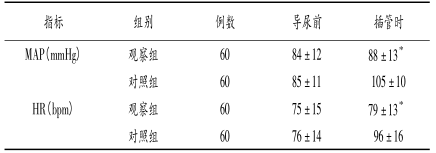
与对照组比较,*P<0.05
2.2两组患者在插管中和插管后镇静和躁动情况观察组患者在插管中以及插管后各项指标优于对照组(P<0.05),见表2。
表2两组患者在插管中和插管后镇静及躁动情况比较[n(%)]
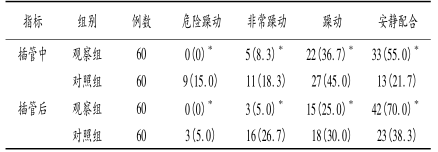
与对照组比较,*P<0.05
2.3两组患者一次导尿成功率、尿道黏膜损伤率及疼痛程度比较两组患者一次导尿成功率、尿道黏膜损伤率比较差异均无统计学意义(P>0.05);疼痛程度观察组明显低于对照组(P<0.05),见表3。
表3两组患者一次导尿成功率、尿道黏膜损伤率及疼痛程度比较
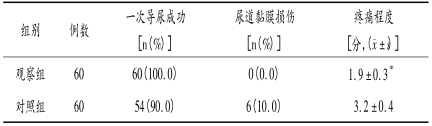
与对照组比较,*P<0.05
3讨论
留置导尿术是ICU围术期经常施行的操作,但由此而产生的术后疼痛与不适也较常见,尤其是男性患者,发生率>70%[5]。泌尿道系统的神经分布主要包括:胸腰段交感神经、骶丛副交感神经、阴部神经。临床上对于男性患者导尿,由于其解剖特点以及个体差异,使导尿插管时尿道损伤、插管不成功等现象时有发生[6]。原因是在插管过程中,尿道处采用石蜡油润滑,尿管上的石蜡油会随着导管深入逐渐变干,使得导尿管的摩擦力增加,阻碍导管通过狭窄区,当插管深入时,会产生一定程度的阻滞感,导致操作时的手法加重,造成尿道损伤,给患者带来痛苦和操作上的失败[7]。ICU的大多数患者会有焦虑与躁动等情绪,主要与各种插管操作有关,为减轻患者的躁动、焦虑,需要尽可能祛除相关的影响因素[8]。本研究提示,采用盐酸奥布卡因凝胶与石蜡油进行润滑尿道比较,盐酸奥布卡因凝胶可有效降低患者插管以及插管后的躁动发生情况,这可能是因为盐酸奥布卡因凝胶具有良好的润滑性能以及止痛性能,盐酸奥布卡因凝胶可对尿道黏膜进行麻醉,从而使尿道黏膜减少对导管的刺激敏感性,降低患者躁动发生率[9]。男性导尿患者如果尿道润滑不充分,容易引起尿道黏膜损伤[10-11]。研究结果表明,比较两组的一次导尿成功率、尿道黏膜损伤率,差异无统计学意义(P>0.05);比较两组插管时的疼痛程度,差异明显,有统计学意义(P<0.05)。表明盐酸奥布卡因凝胶导尿在减少尿道黏膜损伤率、提高一次导尿成功率的基础上,为患者解除了痛苦。
综上所述,盐酸奥布卡因凝胶应用于围术期ICU男性患者导尿,可有效减轻男性患者尿道疼痛,减少躁动及血压的变化,方法简便,效果显著,充分体现护理工作中的人文关怀。
参考文献:
[1]王海霞,李秀峰.成年男性全麻开腹手术导尿时机及方法[J].齐鲁护理杂志,2012,18(8):105
[2]中华医学会重症医学分会.中国重症加强治疗病房患者镇痛和镇静治疗指导意见(2006)[J].中华外科杂志,2006,44(17):1158
[3]佟术艳.疼痛的护理评估[J].中华护理杂志,1995,30(2):123
[4]刘凤英,孔爱玲,王亚金.导尿和留置尿管的护理进展[J].实用护理杂志.1997,13(3):161
[5]AGARWAL A,DHIRAAJ S,PAWARS,et al.An evalua-tion of the efficacy of gabapentin for prevention of cathe-ter-related blad-der discomfort:A prospective,random-ized,placebo-controlled,double-blind study[J].AnesthAnalg,2007,105:1454
[6]段良斌.盐酸奥布卡因凝胶在前列腺增生患者留置导尿管中应用的临床分析[J].中国现代药物应用,2013,7(7):85
[7]李恒,彭辉.盐酸奥布卡因凝胶应用于男性导尿术中的效果观察[J].数理医药学杂志,2015,6(2):247
[8]徐敏.盐酸奥布卡因凝胶在手术中留置导尿管中的应用[J].护理实践与研究,2015,12(1):7
[9]STAV,KOBI,OHLGISSERI,et al.Pain during female u-rethral catheterization:Intraurethral lubricant injectionversus catheter tip lubrication-A prospective randomizedtrial[J].The Journal of Urology,2015,194(4):1018
[10]ERGüN O,GüZEL A,ARMAAN A,et al.A prospec-tive,randomized trial to evaluate the efficacy of clean in-termittent catheterization versus triamcinolone ointmentand contractubex ointment of catheter following internalurethrotomy:long-term results[J].International urologyand nephrology,2015,47(6):909
[11]KYLE G.Lubrication and female catheterization[J].British Journal of Nursing:BJN,2012,20(10):602
(收稿日期:2016-12-29)
相关新闻
04-07
2024
04-07
2024
03-28
2024
02-28
2024
版权所有:沈阳绿洲制药有限责任公司


